
CFDA:首仿優(yōu)先審批!利好這14藥企22個(gè)品種
發(fā)布時(shí)間:2016-07-25 來(lái)源:佚名
近日,CDE給了藥企一個(gè)利好。
7月21日,國(guó)家局藥品審評(píng)中心出臺(tái)了一極為簡(jiǎn)練的《“首仿”品種實(shí)行優(yōu)先審評(píng)評(píng)定的基本原則》。原則總計(jì)249字。從發(fā)布意義上而言,該文件更像部門(mén)工作計(jì)劃調(diào)整的告知函。CDE在該文件從藥品申報(bào)上提出了部門(mén)內(nèi)部的“首仿藥”的定義,并將首仿藥的申報(bào)注冊(cè)納入優(yōu)先范疇。這將大大提速首仿藥物的上市進(jìn)程。
首仿藥需同時(shí)滿足以下條件:
(一) 同品種僅有一家進(jìn)口上市;
(二) 待審評(píng)同品種中,按藥品審評(píng)中心承辦日期先后順序?qū)儆诘谝患业模?/div>
(三) 已經(jīng)超出法定審評(píng)期限。
首仿藥以前無(wú)官方定義
“首仿”概念源于美國(guó)首仿藥的概念,《藥品價(jià)格競(jìng)爭(zhēng)和專(zhuān)利期恢復(fù)法》(Hatch-Waxman修正案)規(guī)定,在“專(zhuān)利無(wú)效或者批準(zhǔn)正在申請(qǐng)的藥物不會(huì)侵犯專(zhuān)利”的情況下,第一個(gè)仿制申請(qǐng)者將擁有180天的市場(chǎng)專(zhuān)賣(mài)權(quán),在此期間,F(xiàn)DA不再批準(zhǔn)相同的ANDA(新藥上市申請(qǐng))。
“首仿藥物”在我國(guó)優(yōu)待地位并不明顯,根據(jù)2016年3月國(guó)家局發(fā)布的《化學(xué)藥品注冊(cè)分類(lèi)改革工作方案》,首仿藥物并不存在以上保護(hù)期。“首仿藥物”價(jià)值更多體現(xiàn)藥品招標(biāo)中,在雙信封制度的技術(shù)評(píng)分的加分。
2005年發(fā)改委在《藥品價(jià)格管理辦法》中提出了首仿概念,定義為國(guó)內(nèi)首先仿制生產(chǎn)并上市銷(xiāo)售的藥物。在2006年國(guó)家發(fā)改委發(fā)布的《藥品定價(jià)辦法》(征求意見(jiàn)稿)一文中,官方提出單獨(dú)定價(jià)藥品的概念,指出“符合下列條件之一的同種仿制類(lèi)藥品,經(jīng)專(zhuān)家論證后,允許在統(tǒng)一定價(jià)基礎(chǔ)上適當(dāng)上浮價(jià)格:……國(guó)內(nèi)首先仿制生產(chǎn)并上市銷(xiāo)售的”。根據(jù)物價(jià)部門(mén)組織的單獨(dú)定價(jià)認(rèn)定流程,由專(zhuān)家論證確定企業(yè)所申報(bào)的產(chǎn)品是否為首仿藥,從而獲得單獨(dú)定價(jià)資格。
而后續(xù)一些省份招標(biāo)文件中,將“首仿藥物”、“單獨(dú)定價(jià)藥物”列為較高質(zhì)量層次,實(shí)行單獨(dú)競(jìng)價(jià)組,或進(jìn)行一定的溢價(jià)處理。
由于部門(mén)間數(shù)據(jù)未有效對(duì)接,且首仿藥的定義在各省招標(biāo)文件的更新,內(nèi)涵不斷延伸,是否為首仿藥在我國(guó)沒(méi)有一個(gè)官方的界定標(biāo)準(zhǔn)。該資格認(rèn)定主要以各省招標(biāo)辦根據(jù)企業(yè)主張及提交的材料審核,在文件公示無(wú)質(zhì)疑后定義為首仿藥物。
但各省招標(biāo)規(guī)則認(rèn)定的首仿藥物,普遍要求:首家仿照國(guó)外專(zhuān)利技術(shù)生產(chǎn)的藥品,以國(guó)家食品藥品監(jiān)督管理局批準(zhǔn)文號(hào)批準(zhǔn)時(shí)間,結(jié)合質(zhì)量標(biāo)準(zhǔn)起草證明為依據(jù),同時(shí)持有新藥證書(shū)的國(guó)產(chǎn)藥品等。
首仿藥規(guī)則寬泛,利好
而本次CDE公布的“首仿藥物”優(yōu)先評(píng)審清單,所列出產(chǎn)品主要為6類(lèi)注冊(cè)(即國(guó)內(nèi)已有上市藥品的仿制),遠(yuǎn)較原來(lái)各省規(guī)則寬泛。
從招標(biāo)的角度而言,如果一家進(jìn)口和一家國(guó)內(nèi)首仿廠家同時(shí)共存,進(jìn)口廠家以過(guò)期原研單列,國(guó)內(nèi)廠家質(zhì)量層次分組中屬于獨(dú)家,此時(shí)國(guó)內(nèi)廠家更希望通過(guò)注冊(cè)法規(guī)獲得更長(zhǎng)的獨(dú)占期而非招標(biāo)意義上的"首仿"。
唯有同產(chǎn)品多家的"首家"廠家更希望從獲批時(shí)間差中獲得價(jià)格優(yōu)勢(shì)和中標(biāo)分組單一貨源供應(yīng)。隨著一致性評(píng)價(jià)的法規(guī)的推進(jìn),藥品招標(biāo)的質(zhì)量分層更加關(guān)注的是否通過(guò)一致性評(píng)價(jià)。
結(jié)語(yǔ):首仿由CDE認(rèn)定,招標(biāo)利好
CDE對(duì)首仿藥的定義中有一個(gè)重要的條件是:已經(jīng)超出法定審評(píng)期限。這個(gè)定義表明只有超過(guò)注冊(cè)時(shí)間的才能補(bǔ)償待遇,這意味如果申報(bào)正常按時(shí)獲批的首仿藥物并沒(méi)有加快。因此這個(gè)今天引起了較多規(guī)則的藥品注冊(cè)政策,可能只是短期政策。而對(duì)一些有多家企業(yè)生產(chǎn)的藥品而言,在藥品招標(biāo)的資質(zhì)認(rèn)定中,也許能通過(guò)CDE的這個(gè)定義獲得一些招標(biāo)優(yōu)勢(shì)。
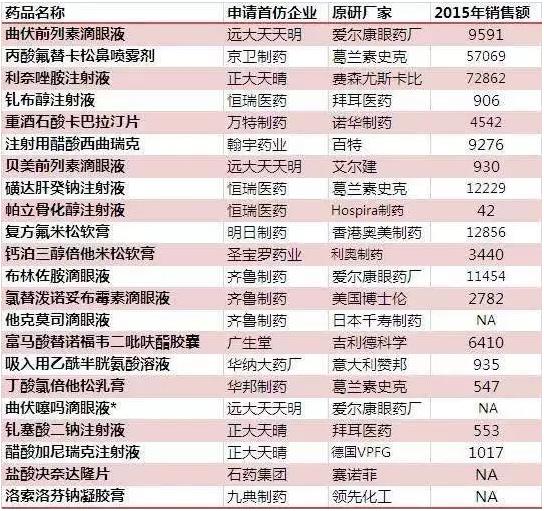
附:首仿藥優(yōu)先審評(píng)名單及2015年市場(chǎng)銷(xiāo)售規(guī)模(萬(wàn)元)






